Perché l'acqua non viene prodotta su larga scala se ne conosciamo la formula molecolare?
La crisi idrica impone di lavorare su nuove tecnologie per il riutilizzo della risorsa più preziosa per la vita. Ma come mai non lo creiamo direttamente da zero nei laboratori, se sappiamo già che H2O è la sua "ricetta"? Ecco la spiegazione.

Conosciamo l'esistenza di diversi metodi fisici e chimici per catturare, desalinizzare, purificare, potabilizzare e ridistribuire l'acqua, al fine di riutilizzare questa risorsa vitale. Sebbene le tecnologie stiano avanzando in questo settore con metodi migliorati e sempre più efficienti, ciò non è sufficiente e la crisi idrica continua ad aggravarsi.
Dall'unione di due atomi di idrogeno (H) e un atomo di ossigeno (O) si ottiene: H₂O (monossido di diidrogeno), che è la formula molecolare dell'acqua. Abbiamo gli ingredienti a disposizione ma, evidentemente, alcuni passaggi di “questa ricetta” non devono essere facili da realizzare in laboratorio, e ci sono ragioni per non crearla in modo industriale.
È possibile fabbricare acqua artificialmente?
Sì, il processo di “produzione” di acqua da zero è possibile, ma ci sono uno (o due) motivi fondamentali per cui non viene fatto in modo massiccio, su scala industriale.
Per questo motivo la scienza è alla continua ricerca di alternative tecnologiche per arrivare al miglior metodo di riutilizzo dell’acqua, perché non siamo in grado di creare fonti inesauribili di “nuova acqua artificiale” su larga scala e tanto meno di installarle in punti strategici del pianeta per porre fine alla crisi idrica. Vi diciamo perché l'acqua non si crea da zero.
Creazione dell'acqua: elettrolisi e fotolisi
L'acqua in laboratorio può essere ottenuta attraverso due processi principali: elettrolisi e fotolisi. L'elettrolisi è il processo mediante il quale l'acqua viene divisa nei suoi componenti di base, ossigeno e idrogeno, applicando una corrente elettrica. L'ossigeno viene rilasciato su un elettrodo e l'idrogeno sull'altro. Questi due gas possono quindi essere raccolti e ricombinati per creare nuovamente acqua. Questo processo viene utilizzato in alcune applicazioni industriali, come la produzione di idrogeno come combustibile.
La fotolisi, invece, comporta la separazione dell'acqua nei suoi componenti fondamentali attraverso l'esposizione alla luce. Ciò si ottiene utilizzando un fotocatalizzatore, che è un materiale che assorbe la luce e catalizza la reazione chimica. L'ossigeno e l'idrogeno possono quindi essere raccolti come nell'elettrolisi.
In entrambi i metodi di creazione è necessaria un’enorme quantità di energia, il che rende questo processo non efficiente ed estremamente pericoloso. Tuttavia, questi processi sono essenziali in alcune applicazioni industriali e possono avere importanti implicazioni per la ricerca sulle tecnologie verdi e la produzione di combustibili puliti.
Progressi nella produzione di acqua
Gli scienziati hanno lavorato per anni per trovare metodi per creare acqua. Un importante gruppo del Dipartimento di Chimica dell'Università dell'Illinois, negli Stati Uniti, ha pubblicato nel 2007 un nuovo modo per produrre acqua evitando grandi esplosioni. In ogni caso questo processo è ancora molto costoso e poco efficiente, ma può essere utilizzato per un altro importante scopo.
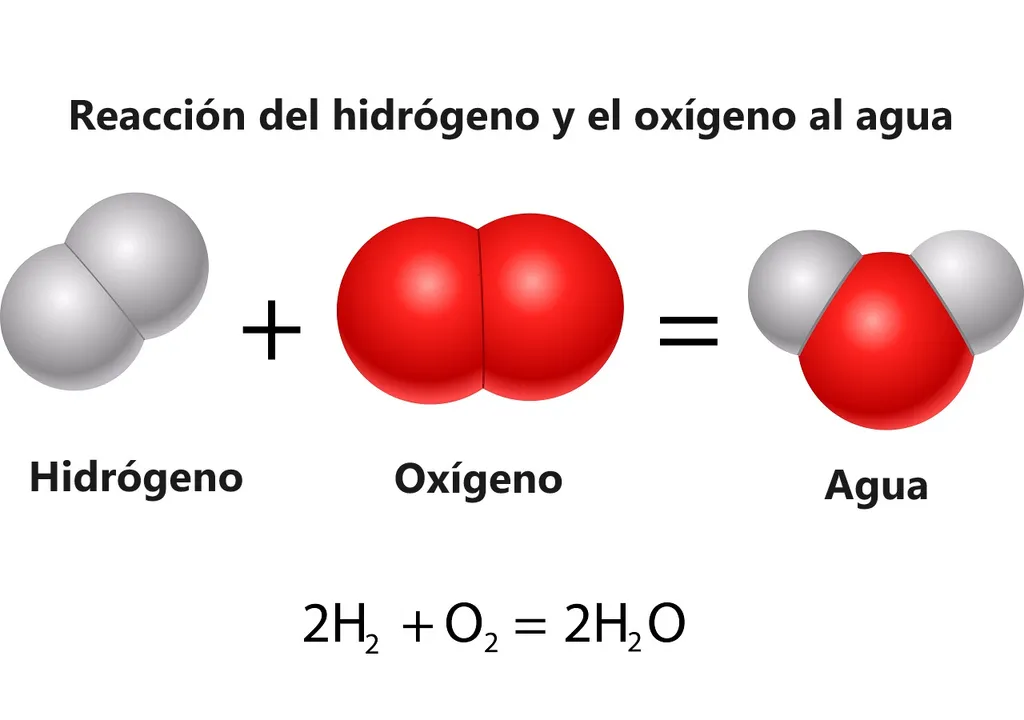
"La reazione (2H2 + O2 = 2H2O + Energia) è nota da secoli, ma fino ad ora nessuno l'aveva fatta funzionare in una soluzione omogenea", ha affermato Thomas Rauchfuss, professore di chimica all'Università e autore principale dell'articolo. La ben nota reazione descrive anche ciò che accade all’interno di una cella a combustibile a idrogeno. In una tipica cella a combustibile, l'idrogeno biatomico (H2) entra in un lato della cella e l'ossigeno biatomico (O2) entra nell'altro lato.

Le molecole di idrogeno perdono i loro elettroni e si caricano positivamente attraverso un processo chiamato ossidazione, mentre le molecole di ossigeno acquistano quattro elettroni e si caricano negativamente attraverso un processo chiamato riduzione. Gli ioni di ossigeno caricati negativamente si combinano con gli ioni idrogeno caricati positivamente per formare acqua e rilasciare energia elettrica.
Il "lato duro" della cella a combustibile è la reazione di riduzione dell'ossigeno, non la reazione di ossidazione dell'idrogeno, ha affermato Rauchfuss. "Tuttavia, abbiamo scoperto che nuovi catalizzatori per la riduzione dell'ossigeno potrebbero anche portare a nuovi mezzi chimici per l'ossidazione dell'idrogeno."
Rauchfuss e Heiden hanno recentemente studiato una generazione relativamente nuova di catalizzatori di idrogenazione di trasferimento da utilizzare come idruri metallici non convenzionali per la riduzione dell'ossigeno. Questi ricercatori si concentrano sulla reattività ossidativa dei catalizzatori di idrogenazione di trasferimento a base di iridio in una soluzione omogenea non acquosa. Hanno scoperto che il complesso di iridio influisce sia sull'ossidazione degli alcoli che sulla riduzione dell'ossigeno.
"La maggior parte dei composti reagiscono con l'idrogeno o l'ossigeno, ma questo catalizzatore reagisce con entrambi", ha detto Heiden. “Reagisce con l'idrogeno per formare un idruro e poi reagisce con l'ossigeno per formare acqua; e lo fa in una cartuccia omogenea e non acquosa. I nuovi catalizzatori potrebbero portare allo sviluppo finale di celle a combustibile a idrogeno più efficienti, riducendone sostanzialmente i costi, ha affermato Heiden.
La soluzione è: non contaminare l'acqua
La cosa principale riguardo al problema della crisi idrica è capire che l’acqua non sta finendo, la quantità di acqua che abbiamo sulla Terra è sempre stata la stessa. Ciò che sta accadendo è che lo stiamo contaminando e in alcune parti non è più facilmente disponibile. Questa è una delle conseguenze della predazione degli ecosistemi (foreste e zone umide, per esempio), che fanno parte del ciclo dell’acqua, filtrano e immagazzinano questa risorsa vitale, lasciandola pulita e in quantità sufficienti.
Dobbiamo quindi fermare l’inquinamento delle acque, dobbiamo moltiplicare la quantità di vegetazione e proteggere gli ecosistemi esistenti. Inoltre, è quanto mai necessario conoscere una gestione e un utilizzo consapevole dell’acqua.
Per dirla in numeri, produrre 1 chilogrammo di carne bovina può consumare tra 500 e 20mila litri di acqua a seconda del paese e del luogo di provenienza della carne. Secondo i dati dell'ONU, l'industria tessile è responsabile del 20% dell'acqua contaminata nel mondo; Ad esempio, per realizzare un paio di pantaloni di jeans sono necessari dai 2 ai 3mila litri d'acqua, secondo uno studio condotto dal Politecnico di Madrid.




