Massima densità a 4 °C: la fisica dell'acqua che protegge la vita
L’acqua è una molecola semplicissima formata da due atomi di idrogeno e uno di ossigeno, ma le sue proprietà fisiche sono tutt’altro che intuitive. Una delle più sorprendenti è il fatto che la sua densità massima non si ha né allo stato solido, né alle temperature più basse del liquido, ma a circa 4 °C.

L’acqua è una molecola semplice, H₂O, ma le sue proprietà fisiche sono tutt’altro che banali. Una delle più sorprendenti è il fatto che la sua densità massima non si abbia allo stato solido, come accade per molti materiali, ma allo stato liquido, intorno a 4 °C. Questa “anomalia” è il risultato diretto di come le molecole d’acqua si organizzano e si legano tra loro.
Le peculiarità dell’acqua
La molecola d’acqua (H₂O) ha una geometria angolare: i due atomi di idrogeno formano un angolo di circa 104,5° con l’ossigeno. Questa disposizione la rende polare (con un lato leggermente positivo e uno leggermente negativo) e le permette di formare numerosi legami a idrogeno con le molecole vicine.
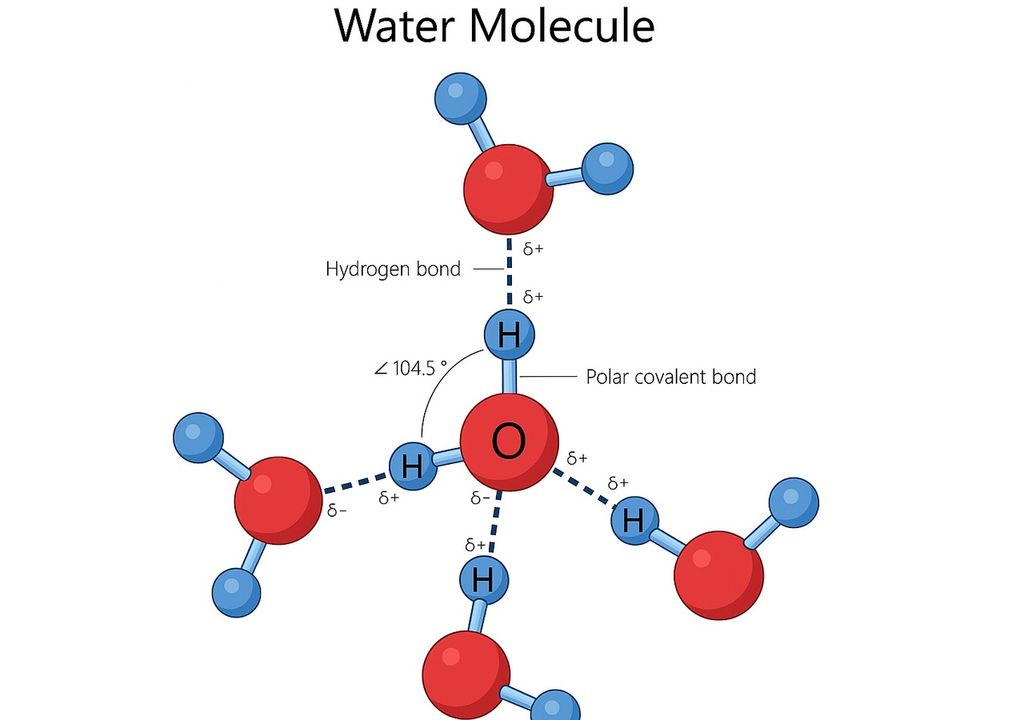
Si tratta di forze di attrazione deboli ma numerosissime, che si esercitano tra l’idrogeno di una molecola e l’ossigeno di un’altra.
Sopra i 4 °C l’aumento di temperatura fa vibrare le molecole, che tendono ad allontanarsi: il liquido si espande e la densità diminuisce, come avviene per quasi tutti i liquidi.
A 4°C le molecole allo stato liquido trovano un loro ordine
Intorno ai 4 °C, però, c’è un equilibrio particolare: la temperatura è abbastanza bassa da permettere molti legami a idrogeno, che riescono ad “incastrare” le molecole in modo compatto, ma non così bassa da farle organizzare in una struttura ordinata e solida come quella del ghiaccio.

Si avvicinano, si allontanano, si riorganizzano continuamente. Il risultato è un impacchettamento molto efficiente, mantenendo però ancora lo stato liquido: stessa massa in meno volume, quindi densità massima.
Questo processo è efficace fino a circa 4 °C, temperatura alla quale le molecole riescono a compattarsi nel modo più efficiente possibile.
Tra 0 e 4 °C , invece, inizia a prevalere la tendenza delle molecole a disporsi in strutture più aperte, precursori del reticolo del ghiaccio. In questo modo si creano più spazi vuoti tra una molecola e l’altra, quindi l’acqua torna a dilatarsi e la densità diminuisce.
Curiosamente proprio come succede per l'acqua con temperature superiori a quella temperatura.
Il coperchio di ghiaccio che preserva la vita
Un esempio classico è il comportamento di un lago in inverno. L’acqua superficiale, raffreddandosi, diventa più densa e affonda fino a raggiungere i 4 °C, formando uno strato stabile sul fondo.

L’acqua che si raffredda ulteriormente sotto i 4 °C, essendo meno densa, resta negli strati più alti e sarà la prima a congelare. Il risultato è che il lago gela dall’alto verso il basso, mentre in profondità si mantiene acqua liquida intorno ai 4 °C, che fa da “rifugio termico” per pesci e altri organismi.
Dal liquido al solido: il reticolo "ingombrante" del ghiaccio
Quando la temperatura scende sotto gli 0 °C, l’acqua passa allo stato solido formando una struttura cristallina esagonale. Ogni molecola d’acqua si lega, tramite i legami a idrogeno, ad altre quattro molecole, in una disposizione tridimensionale ordinata che ricorda una sorta di “impalcatura” aperta.

Questa impalcatura contiene molti spazi vuoti, ed è per questo che il ghiaccio occupa un volume maggiore di quello occupato dall’acqua liquida che lo ha generato. Il ghiaccio è meno denso e quindi galleggia. Gli iceberg, la banchisa, le lastre di ghiaccio sul mare e sui laghi, ma anche un semplice cubetto nel bicchiere sono la manifestazione quotidiana di questa struttura cristallina.
Il ghiaccio, quindi, non galleggia “perché intrappola aria al suo interno”, come spesso si sente dire, ma è la sua struttura, il suo reticolo cristallino organizzato, ad occupare un volume maggiore.